Gli inibitori di pompa protonica (IPP), conosciuti come gastroprotettori, sono farmaci che abbattono la produzione di acido gastrico. Essi, infatti, sono utilizzati per la cura delle patologie acido-correlate, come la malattia da reflusso gastroesofageo e l’ulcera. Gli IPP più utilizzati sono il pantoprazolo, l’omeprazolo, il lansoprazolo e l’esomeprazolo. Generalmente il loro uso è ritenuto sicuro. Tuttavia diversi studi hanno suggerito come l’utilizzo degli IPP, soprattutto a lungo termine, possa associarsi ad un’ampia gamma di effetti indesiderati(si veda fig.1). In questo articolo ci occuperemo degli effetti collaterali degli inibitori di pompa protonica, chiarendo quali sono e quanto solide sono le evidenze che ne supportano l’esistenza.
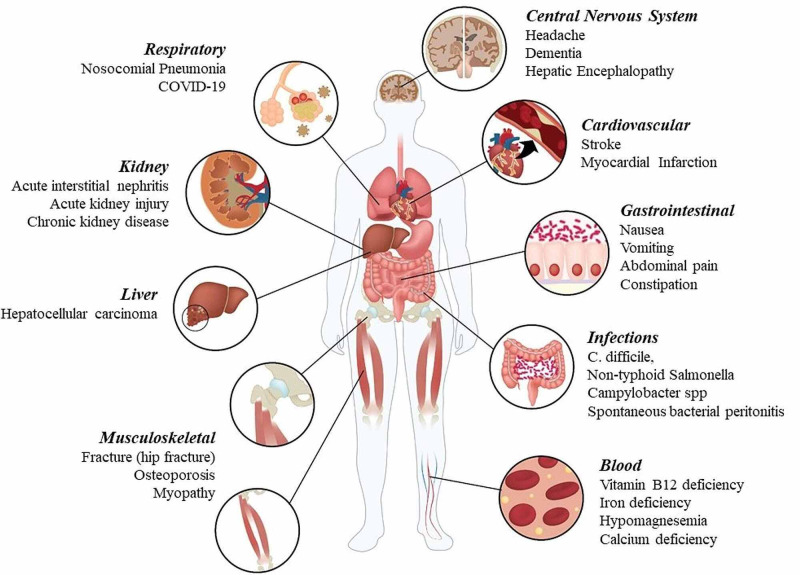
Gli effetti collaterali degli inibitori di pompa protonica
Effetti collaterali comuni
Generalmente nel breve termine (4-8 settimane) gli inibitori di pompa protonica, se utilizzati correttamente, hanno effetti collaterali minori e reversibili. Essi, infatti, possono causare:
- mal di testa;
- rash cutaneo;
- vertigini;
- nausea;
- flatulenza;
- dolore addominale;
- costipazione;
- diarrea.
Nel caso in cui il paziente sperimenti uno o più di questi effetti è consigliabile provare a sostituire il gastroprotettore utilizzato con un altro IPP. Il paziente, infatti, può non avere gli stessi effetti collaterali con IPP diversi. Nel caso invece in cui si continuino ad avere effetti collaterali minori, è consigliabile valutare l’utilizzo di farmaci acido-soppressivi alternativi, come gli H2 antagonisti (ranitidina, etc.).
Malassorbimento dei nutrienti
Numerosi studi hanno dimostrato come la secrezione acida nello stomaco abbia un ruolo fondamentale nell’assorbimento di numerosi micronutrienti introdotti con l’alimentazione. L’utilizzo a lungo termine degli IPP può quindi provocare una riduzione dell’assorbimento e della digestione di vari minerali e vitamine, come la vitamina B12, il ferro, il magnesio e il calcio, la cui carenza può portare allo sviluppo di condizioni patologiche.
Vitamina B12
Diversi studi hanno evidenziato una possibile associazione tra l’uso degli IPP e la carenza di vitamina B12. Un trial clinico ha infatti rilevato che i soggetti anziani che assumono IPP per più di 1 anno hanno una maggiore probabilità di sviluppare un deficit di vitamina B12 rispetto a coloro che non li utilizzano. L’integrazione di vitamina B12 per 8 settimane sembra però migliorare i suoi livelli[2], sebbene un ulteriore studio trasversale, condotto su oltre 500 pazienti geriatrici, abbia mostrato che la carenza permane anche con l’integrazione vitaminica nei soggetti che hanno assunto gli IPP per 3 anni[3].
La carenza di vitamina B12 può causare anemia megaloblastica e, meno frequentemente, sintomi neurologici come, ad esempio, perdita di sensibilità cutanea, vertigini e problemi di vista.
Alla luce di quanto detto, il livello ematico di vitamina B12 deve essere monitorato periodicamente, soprattutto nei pazienti anziani sottoposti a terapia cronica con IPP. L’eventuale integrazione di vitamina B12 potrebbe migliorarne il livello qualora la terapia con i gastroprotettori non possa essere interrotta[4].
Ferro
Sebbene sia noto il ruolo dell’acido gastrico per l’assorbimento del ferro, gli studi circa l’associazione tra l’uso degli IPP e la carenza di ferro sono contraddittori.
Da un lato, infatti, un studio randomizzato e controllato su 60 pazienti affetti da anemia mediterranea in terapia con chelanti del ferro ha mostrato come l’aggiunta di pantoprazolo riducesse ulteriormente i livelli di ferritina rispetto ai controlli[5]. D’altro lato, tuttavia, uno studio condotto su 128 pazienti affetti dalla sindrome di Zollinger-Ellison ha mostrato come l’uso a lungo termine di omeprazolo non avesse causato carenza di ferro[6].
In attesa di studi più ampi, i livelli di ferro dovrebbero essere monitorati nei pazienti che assumono IPP, prestando maggiore attenzione ai soggetti anziani e a coloro nei quali si è sviluppata anemia per altre cause come, ad esempio, le donne in età fertile o i pazienti con malattia infiammatoria intestinale[4].
Magnesio
Diversi studi hanno mostrato che l’uso a lungo termine degli IPP può causare una diminuzione dei livelli sierici di magnesio, la cui carenza può avere anche complicazioni gravi. Se, infatti, nelle sue forme più lievi l’ipomagnesemia può dare sintomi leggeri come crampi e debolezza, le sue forme più severe possono invece avere manifestazioni neuromuscolari e vascolari gravi.
Vale la pena notare che uno dei meccanismi coinvolti nello scarso assorbimento del magnesio è la capacità degli IPP di alterare la composizione del microbiota intestinale. Sembrerebbe, tuttavia, che l’integrazione di una fibra prebiotica, l’inulina, sia in grado di migliorare l’assorbimento dei minerali intestinali, incluso il magnesio[7].
Alla luce di quanto detto, si raccomanda il monitoraggio dei livelli sierici di magnesio nei pazienti che assumono IPP e la sua integrazione in quelli con ipomagnesiemia. In caso di ipomagnesiemia associata agli PPI, la terapia deve essere interrotta[4].
Calcio
L’acido gastrico media l’assorbimento del calcio. Esso, infatti, ne aumenta la solubilità, consentendone l’assorbimento. L’ipocloridria indotta dagli IPP potrebbe quindi causare un’accelerata perdita minerale ossea, con un aumento del rischio di osteoporosi e di fratture ossee.
Diversi studi osservazionali, infatti, hanno dimostrato un’associazione tra l’uso degli IPP e le fratture ossee[8]. Inoltre, uno studio randomizzato, controllato con placebo ha mostrato che un ciclo di 1 settimana di omeprazolo, al dosaggio di 20 mg al giorno, ha ridotto significativamente l’assorbimento frazionato di calcio in condizioni di digiuno nelle donne anziane[9]. Un’ulteriore analisi a posteriori di tre studi prospettici, randomizzati e controllati ha mostrato che l’uso concomitante di IPP e bifosfonati (farmaci per l’osteoporosi) si associa ad un aumento del rischio di fratture rispetto all’uso dei soli bifosfonati. Gli autori dello studio hanno inoltre scoperto che un bisfonato, il risedronato, riduce significativamente il rischio di fratture vertebrali rispetto al placebo, indipendentemente dall’uso concomitante degli IPP[10].
Va notato, tuttavia, che altri studi osservazionali non hanno trovato un’associazione significativa tra l’uso degli IPP e cambiamenti nella densità minerale ossea, nella struttura ossea, né con l’osteoporosi[11].
All luce di quanto detto, la terapia cronica con gli IPP deve essere prescritta con cautela, soprattutto nelle donne anziane e in postmenopausa. Va notato, inoltre, che nei pazienti con aumentato rischio di fratture ossee, il trattamento con risedronato ha mostrato risultati incoraggianti, che non sembrano risentire di un’eventuale terapia concomitante con IPP[4].
Infezioni enteriche
L’effetto terapeutico degli inibitori di pompa protonica è dovuto alla loro capacità di abbattere la produzione di acido nello stomaco. Tuttavia l’ipocloridria indotta dagli IPP indebolisce il principale filtro immunitario del corpo umano, la barriera acida gastirica. Ciò facilita la colonizzazione batterica dell’intestino, crea disbiosi intestinale e rende il corpo maggiormente suscettibile alle infezioni enteriche.
In particolare, diverse meta-analisi hanno confermato una significativa correlazione tra l’uso di IPP e l’infezione da Clostridum difficile[12], un batterio responsabile di una forma grave di diarrea, talvolta fatale, soprattutto nell’anziano e nei pazienti in terapia intensiva. Il rischio d’infezione aumenta ulteriormente se gli IPP sono utilizzati insieme agli antibiotici che, come noto, possono causare disbiosi intestinale, facilitando la proliferazione di C. difficile.
Alcuni studi hanno inoltre suggerito come la disbiosi del microbiota intestinale indotta dall’uso di PPI possa aumentare la vulnerabilità ad altre infezioni enteriche, come quella da Salmonella e Campylobacter. Tuttavia non è possibile escludere che i pazienti coinvolti negli studi avessero un alto rischio di infezioni enteriche prima dell’inizio della terapia con IPP[13].
Infine una meta-analisi ha mostrato come l’uso degli IPP sia associato anche ad un maggior rischio di sovracrescita batterica nell’intestino tenue (SIBO)[14], un disturbo caratterizzato da un’anomala concentrazione di batteri nel primo tratto dell’intestino tenue. L’ipocloridria causata dagli IPP può infatti favorire la colonizzazione batterica di questo tratto intestinale, causando sintomi da maldigestione come gonfiore e flatulenza. Va notato, tuttavia, che quest’associazione è emersa solo utilizzando test diagnostici per la SIBO altamente specifici (coltura dell’aspirato duodenale o digiunale).
Malattie del fegato
Alcuni studi hanno suggerito una possibile associazione tra l’uso degli IPP e alcuni disturbi epatici. In particolare, l’ipocloridria indotta dagli IPP può causare proliferazione di Enterococchi a livello intestinale, che possono aggravare l’epatopatia alcolica[15]. La proliferazione batterica nell’intestino tenue potrebbe inoltre spiegare l’aumento del rischio di encefalopatia epatica nei pazienti cirrotici che utilizzando gli IPP[16]. Tuttavia l’evidenza circa l’associazione tra IPP e malattie del fegato è limitata ed è quindi prematuro trarre conclusioni sulla loro effettiva causalità.
Peritonite batterica spontanea
L’uso degli IPP è stato associato anche ad un aumento del rischio di peritonite batterica spontanea (PBS) nei pazienti cirrotici. La PBS potrebbe essere favorita dall’aumento della proliferazione batterica intestinale e da un’alterata permeabilità intestinale che, a sua volta, potrebbe portare alla traslocazione di batteri dall’intestino all’ascite. Tuttavia l’evidenza circa l’associazione tra PBS e IPP è incerta. Alcuni recenti studi prospettici, infatti, non sono riusciti a stabilire un’associazione statisticamente significativa[17]. Se la terapia con PPI nei pazienti cirrotici costituisca o meno un reale aumento del rischio di SBP rimane quindi controverso.
Polmonite
Alcune ricerche suggeriscono che l’uso degli inibitori di pompa protonica può essere associato a un aumentato rischio di polmonite acquisita in comunità (o “community acquired pneumonia” – CAP), ma le prove sono contrastanti e complesse. Si ritiene che la ridotta acidità gastrica causata dagli IPP possa contribuire a questo rischio in vari modi, tra cui la possibilità che i batteri raggiungano le vie respiratorie attraverso il fisiologico reflusso gastroesofageo. Tuttavia, i dati a sostegno di questi meccanismi sono incerti, e alcuni studi non hanno riscontrato alcuna associazione tra l’uso di IPP e la CAP. Sono quindi necessari ulteriori studi per chiarire la relazione tra l’uso degli IPP e la polmonite.
Disturbi renali
Diversi studi hanno evidenziato come l’uso degli inibitori di pompa protonica si associ a diversi disturbi renali, come la nefrite interstiziale acuta, il danno renale acuto e la malattia renale cronica. Sebbene gli studi presentino alcuni limiti metodologici, nel complesso le meta-analisi suggeriscono che l’uso di PPI può associarsi ad un aumento del rischio di eventi avversi renali[18], di cui il più comune è la nefrite interstiziale acuta.
Nei pazienti che assumono IPP, soprattutto nei soggetti più giovani, è quindi importante monitorare la funzionalità renale. In caso di disfunzione renale, si consiglia di sospendere il trattamento con IPP e di prendere in considerazione la terapia con antinfiammatori steroidei. Nei pazienti che necessitano di terapia antiacida, è possibile valutare l’utilizzo di farmaci alternativi come gli H2 antagonisti (ranitidina, etc.)[4].
Disturbi cardiovascolari
Alcuni studi hanno suggerito una possibile associazione tra l‘uso a lungo termine degli IPP e l’aumento di disturbi cardiovascolari, tra cui la sindrome coronarica acuta, l’ictus e le aritmie. Gli inibitori di pompa, infatti, potrebbero compromettere la funzione dell’endotelio vascolare, accelerandone l’invecchiamento. Tuttavia diversi atri studi non hanno confermato quest’associazione.
In attesa di evidenze maggiormente dirimenti, è possibile valutare la sostituzione degli IPP con una combinazione di farmaci H2 antagonisti e antiacidi nei pazienti con aumentato rischio cardiovascolare[4].
Tumori gastrici
Negli ultimi anni alcuni studi hanno mostrato una possibile associazione tra l’utilizzo a lungo termine degli inibitori di pompa e un aumento del rischio di tumori gastrici. È possibile, infatti, che un’iperproduzione di gastrina dovuta alla soppressione prolungata dell’acido gastrico, possa favorire lo sviluppo di lesioni precancerose e neoplastiche. Tuttavia altri studi non hanno mostrato una chiara correlazione tra IPP e cancro dello stomaco. L’evidenza è quindi contrastante. Tuttavia è consigliabile valutare con attenzione l’uso a lungo termine degli IPP nei pazienti che presentino fattori di rischio per il tumore dello stomaco, come l’infezione da H. pylori e eventuali lesioni precancerose[4].
Disturbi neurologici
L’uso a lungo termine degli IPP è stato associato anche a disturbi di ordine neurologico, tra cui la demenza e sintomi aspecifici come il mal di testa, le vertigini e, più raramente, la depressione, la diplopia, disturbi del sonno, agitazione, tremore e allucinazioni[19]. In particolare le evidenze circa il legame tra IPP e demenza sono contrastanti. È possibile, inoltre, che i disturbi neurologici associati all’uso continuativo degli IPP possano derivare da eventuali carenze di vitamina B12 che, come noto, possono dare questo tipo di manifestazioni.
Conclusioni
Negli ultimi anni sono stati segnalati i più diversi effetti collaterali associati all’uso degli inibitori di pompa protonica. Si tratta, tuttavia, di studi osservazionali, spesso condotti su pazienti anziani, che possono essere portatori di altri disturbi, in realtà causa degli effetti avversi attribuiti impropriamnte agli IPP. Spesso, inoltre, i risultati delle ricerche sono contrastanti e, nondimeno, gli aumenti del rischio evidenziati sono solo moderati. Le evidenze circa i possibili effetti collaterali degli IPP vanno quindi interpretate con cautela, soprattutto quando frutto di studi osservazionali pluriennali, durante i quali la probabilità di fattori confondenti cresce sensibilmente.
Va notato, tuttavia, che alcuni effetti collaterali appaiono più plausibili e consolidati di altri. Tra questi vi è il rischio di malassorbimento di nutrienti, di infezioni enteriche e di nefrite interstiziale acuta.
In definitiva, i vantaggi derivanti dall’uso degli inibitori di pompa protonica superano i loro possibili costi. Essi, infatti, permettono la remissione di disturbi gastrointestinali che, se non opportunamente curati, possono portare a complicanze serie. Tuttavia è fondamentale essere consapevoli dei loro potenziali effetti collaterali, in modo da poter adottare eventuali precauzioni. Gli IPP, inoltre, devono essere utilizzati solo quando essi sono indicati, per il tempo e al dosaggio minore efficace possibile.
Bibliografia
- Yibirin M, De Oliveira D, Valera R, Plitt AE, Lutgen S. Adverse Effects Associated with Proton Pump Inhibitor Use. Cureus. 2021 Jan 18;13(1):e12759.
- Rozgony NR, Fang C, Kuczmarski MF, et al. Vitamin B(12) deficiency is linked with long-term use of proton pump inhibitors in institutionalized older adults: could a cyanocobalamin nasal spray be beneficial? J Nutr Elder. 2010; 29: 87-99.
- Dharmarajan TS, Kanagala MR, Murakonda P, et al. Do acid-lowering agents affect vitamin B12 status in older adults? J Am Med Dir Assoc. 2008; 9: 162-167.
- Castellana C, Pecere S, Furnari M, et al. Side effects of long-term use of proton pump inhibitors: practical considerations. Pol Arch Intern Med. 2021; 131: 541-549.
- Eghbali A, Khalilpour A, Taherahmadi H, et al. Pantoprazole reduces serum ferritin in patients with thalassemia major and intermedia: a randomized, controlled study. Therapie. 2019; 74: 507-512.
- Stewart CA, Termanini B, Sutliff VE, et al. Iron absorption in patients with Zollinger-Ellison syndrome treated with long-term gastric acid antisecretory therapy. Aliment Pharmacol Ther. 1998; 12: 83-98.
- Hess MW, de Baaij JH, Broekman M, et al. Inulin significantly improves serum magnesium levels in proton pump inhibitor-induced hypomagnesaemia. Aliment Pharmacol Ther. 2016; 43: 1178-1185.
- Yu EW, Bauer SR, Bain PA, Bauer DC. Proton pump inhibitors and risk of fractures: a meta-analysis of 11 international studies. Am J Med 2011; 124: 519–26.
- O’Connell MB, Madden DM, Murray AM, et al. Effects of proton pump inhibitors on calcium carbonate absorption in women: a randomized crossover trial. Am J Med. 2005; 118: 778-781.
- Roux C, Goldstein JL, Zhou X, et al. Vertebral fracture efficacy during risedronate therapy in patients using proton pump inhibitors. Osteoporos Int. 2012; 23: 277-284.
- Targownik LE, Lix LM, Leung S, Leslie WD. Proton-pump inhibitor use is not associated with osteoporosis or accelerated bone mineral density loss. Gastroenterology. 2010 Mar;138(3):896-904.
- Kwok, Chun Shing MBBS, MSc, BSc1; Arthur, Aaron Kobina BSc1; Anibueze, Chukwudubem Ifeanyichukwu1; Singh, Sonal MD, MPH2; Cavallazzi, Rodrigo MD3; Loke, Yoon Kong MBBS, MD1. Risk of Clostridium difficileInfection With Acid Suppressing Drugs and Antibiotics: Meta-Analysis. American Journal of Gastroenterology 107(7):p 1011-1019, July 2012.
- Brophy, Sinead PhD1; Jones, Kerina H PhD1; Rahman, Muhammad A PhD1; Zhou, Shang-Ming PhD4; John, Ann MD5; Atkinson, Mark D PhD1; Francis, Nick PhD7; Lyons, Ronan A MD8; Dunstan, Frank PhD9. Incidence of Campylobacter and SalmonellaInfections Following First Prescription for PPI: A Cohort Study Using Routine Data. American Journal of Gastroenterology 108(7):p 1094-1100, July 2013.
- Lo WK, Chan WW. Proton pump inhibitor use and the risk of small intestinal bacterial overgrowth: a meta-analysis. Clin Gastroenterol Hepatol. 2013 May;11(5):483-90.
- Llorente C, Jepsen P, Inamine T, Wang L, Bluemel S, Wang HJ et al. Gastric acid suppression promotes alcoholic liver disease by inducing overgrowth of intestinal Enterococcus. Nat Commun 2017; 8: 837.
- Dam G, Vilstrup H, Watson H, Jepsen P. Proton pump inhibitors as a risk factor for hepatic encephalopathy and spontaneous bacterial peritonitis in patients with cirrhosis with ascites. Hepatology (Baltimore, MD) 2016; 64: 1265–72.
- Miozzo SA, Tovo CV, John JA, et al. Proton pump inhibitor use and spontaneous bacterial peritonitis in cirrhosis: an undesirable association? J Hepatol. 2015; 63: 529-530.
- Yang Y, George KC, Shang WF, Zeng R, Ge SW, Xu G. Proton-pump inhibitors use, and risk of acute kidney injury: a meta-analysis of observational studies. Drug Des Develop Therapy 2017; 11: 1291–9.
- Sebastián Domingo JJ. Omeprazole-induced hallucinations. Not as rare as you might think. Gastroenterol Hepatol. 2018 Apr;41(4):266-267. English, Spanish. doi: 10.1016/j.gastrohep.2017.05.002. Epub 2017 Jul 29. PMID: 28625416.


